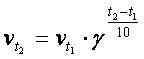Kimyəvi reaksiya haqqında əsas
məlumatları əldə etmək üçün onun sürətini bilmək vacibdir. reaksiya
sürətinin təyin edilməsi ilə kimyəvi kinetika məşğul olur.
Kimyəvi reaksiyanın sürəti hər şeydən
əvvəl reaksiyaya daxil olan maddələrin təbiətindən və həmçinin onların
qatılığından, temperaturdan katalizator iştirakından və s.-dən asılıdır.
Reaksiyanın sürəti reaksiyaya daxil
olan və reaksiya nəticəsində əmələ gələn maddələrin qatılığının zaman vahidi
ərzində dəyişməsi ilə xarakterizə olunur. Məsələn reaksiyanın sürətininin
dəqiqədə 0,5 mol/l olması həmin zaman vahidində reaksiyaya daxil olan
maddələrin qatılığının 1 litrdə 0,5 mol azalması deməkdir.
Homogen sistemdə reaksiya bütün həcmdə
gedir. Heterogen sistemdə isə hissəciklər yalnız fazaların səthində
qarşılıqlı təsirdə olur. Bununla əlaqədar olaraqhomogen və heterogen
reaksiyaları sürətləri müxtəlif cür təyin edilir.
Homogen reaksiyanın sürəti vahid
zamanda və vahid həcmdə reaksiyaya daxil olan və ya reaksiyadan alınan
maddələrdən birinin maddə miqdarının dəyişməsi ilə ifadə olunur: vhomog=Δν/VΔτ
Heterogen
reaksiyanın sürəti isə vahid zamanda fazalararası vahid səthdə reaksiyay
daxil olan və ya alınan maddələrdən birinin maddə miqdarının dəyişməsi ilə
ifadə olunur: vheterog=Δν/SΔτ
Reaksiyanın sürəti həmçinin sistemin
müəyyən bir göstəricisinin (rəngin, elektrik keçiriciliyinin, təzyiqin və
s.) dəyişmə sürətinə görə də müəyyən edilə bilər.
Kimyəvi reaksiyanın sürəti vaxt
keçdikcə zəifləyir. Bu onunla əlaqədardır ki, vaxt keçdikcə, məhlulda
reaksiyaya daxil olan molekulların sayı bir qayda olaraq azalır.
Kütlələrin təsiri qanununa əsasən
reaksiyaya daxil olan maddələrin qatılığının artırılması reaksiya sürətini
artırır.
Qaz fazada gedə reaksiyaların sürətinə
təzyiqin artması müsbət təsir göstərir.
Kimyəvi reaksiyanı sürətinə
katalizatorlar güclü təsir göstərir.
Temperaturun artmasıyla kimyəvi
reaksiyanın sürəti adətən sıçrayışla artır.
Reaksiya sürəti ilə temperatur
arasındakı asılılığı ifadə etmək üçün Arrenius (1899) aşağıdakı tənliyi
müəyyən etmişdir:
d ln k / d T = A / RT2
burada k-reaksiyanın sürət əmsalı, T-
mütləq temperatur, R - universal qaz sabiti, A - aktivləşmə enerjisidir.
Reaksiyada iştirak edən maddələrin bir
molundakı molekulların reaksiyaya daxil olması üçün vacib olan enerjiyə
aktivləşmə enerjisi deyilir.
Kimyəvi reaksiyanın sürəti ilə
temperatur arasındakı asılılığa dair Vant-Hoff (1884) qaydası da məlumdur.
Bu qayda aşağıdakı kimi ifadə olunur:
Bir çox hallarda sistemin
temperaturunun 10 0C atması nəticəsində kimyəvi reaksiyanın
sürəti təxminən 2-4 dəfə artır: